この記事は、活性酸素について調べてみたの補足記事です。不対(ふつい)電子があると不安定になり他の物質と結合しやすくなるのはなぜなのか。原子が持つ最外殻電子数と、共有結合について知り、ラジカルを理解します。先に、「活性酸素について調べてみた」をお読み下さい。


周期表から原子番号とその意味を知る
これは高校生が化学で習う元素の周期表です。第三周期までを示しています。
私も高校生の時に、「水兵リーベ僕の船そう曲がるシップスクラー(ク)」と覚えさせられました。幸いなことにまだ覚えていました。
この中で、体にとって特に重要な元素は、C(炭素)、H(水素)、O(酸素)、N(窒素)、S(イオウ)、P(リン)でしょうか。人の体は食べたものでできていますが、炭水化物も、脂肪も、タンパク質もこの元素があれば、ほぼつくることができます。もちろん、体の60~70%を占める水も。
| 原子番号 | 1 | 2 | ||||||
| 元素名 | H 水素 |
He ヘリウム |
||||||
| 最外殻の電子数 | 1 | 2 | ||||||
| 原子番号 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 元素名 | Li リチウム |
Be ベリリウム |
B ホウ素 |
C 炭素 |
N 窒素 |
O 酸素 |
F フッ素 |
Ne ネオン |
| 最外殻の電子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 原子番号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 元素名 | Na ナトリウム |
Mg マグネシウム |
Al アルミニウム |
Si ケイ素 |
P リン |
S イオウ |
Cl 塩素 |
Ar アルゴン |
| 最外殻の電子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
陽子の数と電子数は同じ
表には原子番号が書かれています。
原子番号とは、原子核の中にある陽子の個数を表した数字です。そして、原子核のまわりには電子が周回しています。陽子の数と電子の数は同じです。
つまり、原子番号1の水素には、電子が1個、原子番号8の酸素には電子が8個存在します。たとえば、下図はヘリウム(He)です。原子核の中に陽子は2個。電子も2個あります。
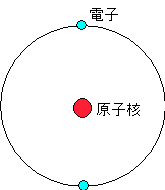
次に、周期表に書かれていた最外殻の電子数(薄いブルーで塗ってある数字)について説明していきます。
電子殻
上で、原子番号1の水素には、電子が1個、原子番号8の酸素には電子が8個存在します、と書きました。その他の元素も同じです。原子番号11のナトリウムには電子が11個、原子番号17の塩素には電子が17個存在します。
これらの電子はバラバラに回っているわけでなく、電子殻(でんしかく)と呼ばれる電子軌道の集まり、もう少しいうと、電子の収容場所におさめられます。
最外殻の電子数とは、原子核の周りにある電子殻のうち、一番外側にある電子殻に入っている電子の数を表しています。
電子は小軌道に2個揃うと安定する
電子殻は、K殻・L殻・M殻・N殻・・・と順番が決められ、電子は必ずK殻から入って行きます。さらに、それぞれ一番外側の電子殻には、電子が2個ずつ入る「小軌道」があり、各小軌道での電子収容数の和がその電子殻での収容数となります。
| 殻 | 電子数 |
| K殻 | 2 |
| L殻 | 8 |
| M殻 | 18 |
下の表を見てください。これは、最外殻にある電子を点で表したものです。電子式といわれます。次にこの表を見ながら電子殻のK殻、L殻、M殻について説明します。
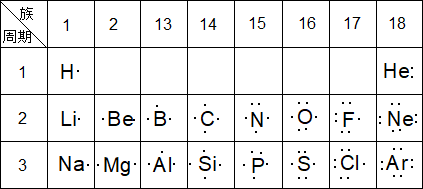
電子式
K殻
K殻には電子が2個入ります。
第1周期の水素(H)とヘリウム(He)にはK殻しかありません。ヘリウムに電子が2個入り、安定した状態になり他のものと反応しません。
L殻
L殻には電子が8個入ります。
第2周期の原子番号3のリチウム(Li)から原子番号10のネオン(Ne)までは、K殻とL殻があります。第2周期の原子は、全てまずK殻に2個電子が入ります。
次に、その外側にあるL殻に電子が入って行きます。第2周期では、L殻が最外殻になります。
電子が2個ずつ入る小軌道は4個ありますが、表にあるように最初に小軌道に1個ずつ入り、それから2個目が入って行きます。そして小軌道全てに2個ずつ電子が入ったネオン(Ne)は安定して、他のものと反応しません。
M殻
M殻には電子が18個入りますが、そのうち10個は電子が入る優先順位が低いです。L殻と同じように8個の電子が小軌道に入ると考えます。
このあたりのことは、ウイキペディアの電子殻を読むとより詳細な説明が書かれています。私は基本的に高校化学程度で理解できる範囲を想定しているので、これ以上深入りしません。
第3周期の原子番号11のナトリウム(Na)から原子番号18のアルゴン(Ar)までは、K殻とL殻とM殻があります。第3周期の原子は、全てK殻とL殻に電子が入っています。第3周期ではM殻が最外殻になります。
そのため、表を見ていただくとお分かりになると思いますが、ナトリウムからアルゴンまで第2周期と同じような電子式になります。アルゴン(Ar)は安定していて他のものと反応しません。
希ガスは安定している
18族のヘリウム、ネオン、アルゴンは希ガス(不活性ガス)と呼ばれています。安定していて他のものと結合することはありません。
それぞれの電子殻にすべて電子が入っている状態です。ヘリウム(He)はK殻に電子が2個入っています。ネオン(Ne)は、K殻に電子が2個、L殻に8個入っています。アルゴン(Ar)は、K殻に電子が2個、L殻に8個、M殻に8個入っています。
このことはよく覚えておいて下さい。
不対電子
電子式の表に書かれている元素には、最外殻に入っている電子を点で表しています。電子が2個ずつ4個の小軌道に入るようになっています。
しかし、見ての通り、電子が1個しかない箇所が多いです。この1個で存在している電子を不対(ふつい)電子と呼びます。対(つい)は2個の意味ですから、対でない電子という意味です。
不対電子は、もう1個電子が来ると2個になって小軌道が安定します。さらに、4組の最外殻が全て電子で埋まると、配置が希ガスと同じになりさらに安定します。
希ガス以外の不対電子をもつ原子は、他の原子と結合して希ガスのように電子殻を電子で埋めて安定しようとします。
イオン結合
上で紹介した元素のうち、リチウム(Li)、ベリリウム(Be)、ナトリウム(Na)、マグネシウム(Mg)、アルミ(Al)は金属です。それ以外は非金属です。
金属と非金属の結合はイオン結合です。一番わかりやすいNaCl(塩化ナトリウム)について説明しましょう。
塩化ナトリウム(食塩)の反応
ナトリウム(Na)はM殻に電子が1個あります。一方、塩素(Cl)はM殻に電子が7個あり、そのうち1個が不対電子になっています。
このとき、ナトリウム(Na)から電子が1個放出されると、ネオン(Ne)と同じ電子配置になります。しかし、陽子に対して電子が1個足りないので、電荷は+になります。
一方、塩素(Cl)は電子を1個もらえると、アルゴン(Ar)と同じ電子配置になります。こちらは電子が1個多いので、電荷は-になります。
ナトリウム(Na)も塩素(Cl)も安定し、Na+とCl-は、静電気力で引き合って結びつきます。
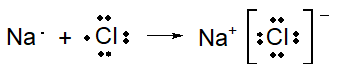
イオン結合はこの記事の本題ではないので、これくらいにします。大切なのは、次の共有結合です。
共有結合
非金属の原子同士が結合する時、不対電子を解消し、希ガスと同じ電子配置になるように結合します。イオン結合と原則は同じですが、少し違っています。
イオン結合は、お互いに電子のやりとりをして、電荷がプラスやマイナスになりましたが、共有結合は、不対電子をお互いに共有して解消するのです。
電子式をもとに、水素(H2)、水(H2O)、アンモニア(NH3)、メタン(CH4)を書いてみましょう。
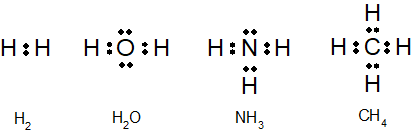
水素(H2)
水素(H)は電子を1個持ちます。水素分子になると2個の電子を共有します。これでヘリウムと同じく最外殻は満杯です。
水(H2O)
水は、酸素(O)の最外殻に6個の電子があり、そのうち2組の小軌道には電子が2個ずつ入っています。それ以外の不対電子に水素がそれぞれ1個ずつついて、8個の電子になり、酸素の最外殻は満杯です。
アンモニア(NH3)
アンモニアは、窒素(N)の最外殻に5個の電子があります。そのうち1組の小軌道には電子が2個入っています。残りの3個の不対電子に水素が3個ついて、8個の電子になり窒素の最外殻は満杯です。
メタン(CH4)
メタンは、炭素(C)の最外殻に4個の電子があり、それぞれが不対電子です。そこに4個の水素がついて、8個の電子になり炭素の最外殻は満杯です。
最外殻が満杯になると原子が安定します。このような原子同士の結合を共有結合といいます。
酸素(O)、窒素(N)、炭素(C)原子には、8個の電子がついてネオン(Ne)と同じ電子配置になっています。
ラジカルについて考えてみる
ラジカルは、イオン結合や共有結合とは違っていて、分子が電子をもらっても希ガスと同じ電子配置にならず、不対電子が増えます。つまり不安定になります。
スーパーオキシド
スーパーオキシドは、酸素分子(O2)に電子が1個結合します。下図上段は、酸素分子の生成です。酸素分子は、不対電子が2個あるのですが、この形で安定しています。
その下がスーパーオキシドができる反応式です。酸素分子に電子が1個結合すると、不対電子が1個になり、この場所が電子を要求します。
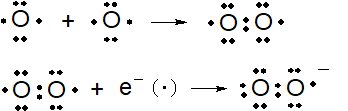
ヒドロキシルラジカル
ヒドロキシルラジカル(・OH)は、過酸化水素(H2O2)から発生します。またOHと聞くと、水酸化物イオン(OH-)を思い出します。どのように違うのでしょう?
水酸化物イオンは、電子配置がネオン(Ne)と同じですが、ヒドロキシルラジカル(・OH)には不対電子が1個あり不安定です。
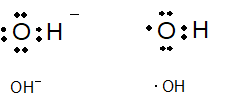
酸化は、酸素と結合することが一番分かりやすい説明ですが、相手から電子を奪うことも酸化です。ラジカルの酸化力は、不対電子があるので、安定するためには相手から電子を奪う必要があるのです。
まとめ
この記事は、活性酸素について調べてみたの補足記事として書きました。

物質は安定したがっている。それがこの記事を書いていて感じたことです。